 |
|---|
| 〜 特 別 寄 稿 〜 砒素の地球科学 ― 海洋堆積物中における砒素の挙動 ― |
|||
 |
北海道東海大学工学部 海洋環境学科 助教授 南 秀樹 |
|
|
| 1.はじめに 皆さんがもっている“砒素”という元素のイメージは“毒”ではないでしょうか?砒素はテレビドラマや推理小説にもよく登場しますので、ある意味身近な元素かもしれません。現実には砒素の分析を行っていると聞いただけで一般の人はまず近寄ってはきませんし、標準試薬を購入しても試薬瓶にはドクロマークが大きく描かれおり、その取り扱いには注意を払わなくてはなりません。海洋の生物はこの“毒”を無毒化するために有機金属化合物に変換すると考えられています。それではこのあまりイメージの良くない“砒素”が海洋の中でどのような挙動を示すのか説明していきます。 2.海洋への供給と除去 陸上における砒素は、岩石の風化、土壌の侵食等の作用によって、河川や大気を経由し海洋に運ばれます。その他に殺虫剤や除草剤および化石燃料等にも砒素は含まれており、このような人為起源の砒素も環境中に放出されると河川水に溶けて、あるいはエアロゾル(大気中に存在する小さな塵)として大気中に浮遊し海洋に輸送されます(図1)。 砒素は地殻中における存在量は2ppm、海水中の平均濃度も2.3ppbと低く、海水中では微量元素の一つです。また、海水中の平均滞留時間(海水の中に留まっている時間)は 2×106年であることが知られており(角皆・乗木、1983)、同族の栄養塩類の代表であるリンの1×105年に比べれば20倍も長い間海水中に溶けていることになります。ただし、海水中の主要元素(例えばナトリウムなどは8×108年)に比べれば、海水から比較的除去されやすい元素です。なお、セジメントトラップ(海水中に吊るして沈降粒子を捕集する器)の研究によると砒素はセレン、アンチモン、銀、亜鉛、臭素などと同様に沈降粒子の有機画分と共に海水中から除かれる元素に分類することができます(Masuzawa, 1989)。 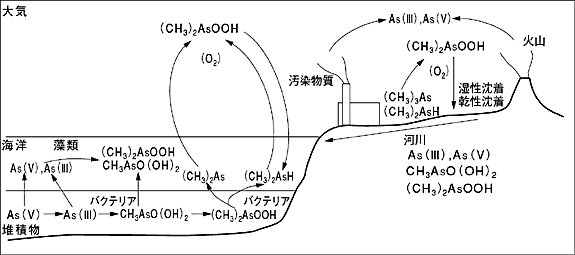 図1 大気−海洋間における砒素の生化学的循環 参考文献(11)の図を改訂して引用 3.海水中における挙動 海水中における砒素は、主として砒酸塩(HAsO42−)、亜砒酸塩(HAsO32−)、メチル砒素(CH3AsO(OH)O−)、2メチル砒素((CH3)2AsOO−)の4つの化学形を持つことが知られています(Braman and Foreback, 1973;Braman, 1975)。一般的には5価の砒酸塩が熱力学的にも卓越種ですが、海洋表層の有光層においては3価の亜砒酸塩およびメチル化した砒素の存在が指摘されています。この2つの化学種は特に有光層において、海洋における基礎生産の指標であるクロロフィルaの濃度と14Cの取り込み速度と密接に関係があると言われています。したがって、砒素の存在形にも生物活動が大きく影響を及ぼしているものと考えられています。 海水中における砒素の分布は様々な海域で報告されていますが、一般にその濃度は表層水で低く、深層水で高い傾向を示します。すなわち、海洋での砒素の鉛直分布は同族元素であるリン酸塩のそれとよく類似しています。この鉛直分布となる要因は栄養塩と同様な海洋表層における生物による砒素の摂取、そして深層の無光層における有機態砒素の分解および回帰の結果であると考えられています。この他にも外洋の底層水では、砒素と同様にオキソ酸の陰イオンの形で溶存しているバナジウムとも挙動を共にしていることが報告されています(Middelburg et al., 1988)。 4.堆積物中における挙動 堆積物および間隙水(堆積物に含まれる水)中の砒素の挙動については、北太平洋の実際のデータを見ながら説明していきます。実験海域を富栄養である親潮海域(日高沖)と貧栄養である黒潮海域(四国沖)に別けて観測しました。なお、親潮海域の方が基礎生産量は2〜10倍高いことが報告されています(Saijo and Ichimura,1960)。 |
| 間隙水中の砒素の鉛直分布を見ると、同じ1000mの水深で採取した堆積物でもその濃度が大きく異なることがわかります(図1)。これは表層で有機物粒子に取り込まれた砒素が海底まで到達し、その後有機物の分解に伴って間隙水へ溶解したためで、生物生産の大きな違いを反映したものと思われます。 次に堆積物表層に注目して、砒素の水平分布を観察してみます。親潮海域では水深の増加と共に減少する傾向を示します(図3)。これは親潮海域では表層の生物生産が沿岸から外洋に向かって減少し、海底に到達する砒素の量が減少するためと考えられます。黒潮海域では逆に増加しています。この理由は他の金属元素の影響で説明することができます。堆積物中の主要元素である鉄やマンガンは還元的な海底環境では海底に到達しても堆積することができず、拡散などの効果により外洋に運ばれ外洋の酸化的な環境になると酸化物を形成して堆積します。黒潮海域の海底環境は亜酸化的ですので海底に到達した砒素がその挙動に応答しているものと考えられるのです(図4)。 当然外洋の方が表層の生物生産も少なくなるので、有機物の影響は少なくなるのですが、それに比べて金属元素による砒素の取り込みの割合が多いため、外洋域で高くなるのです。このような金属元素への砒素の濃縮現象は、マンガンノジュ−ル中に砒素が濃縮しているといった報告からも支持されます(Takematsu, |
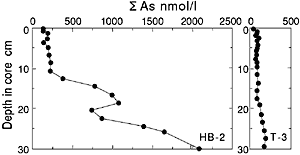 図2 間隙水中のΣAs=(As(III)+As(V))の鉛直分布 HB-2は日高沖の日高舟状海盆の1080mで採取した堆積物 T-3は四国沖の大陸斜面の水深1060mで採取した堆積物 参考文献(12)の図を改訂して引用 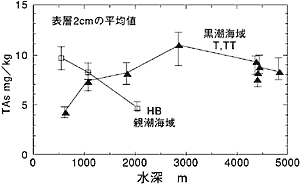 図3 表層堆積物中のTAs=(As(III)+As(V))と水深の関係 T-3は四国沖の大陸斜面の水深1060mで採取した堆積物 HB-2は日高沖の日高舟状海盆の1080mで採取した堆積物 参考文献(12)の図を改訂して引用 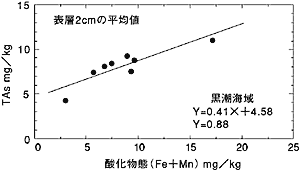 図4 表層堆積物中のTAs=(As(III)+As(V))と酸化態(Fe+Mn) の関係 参考文献(12)の図を改訂して引用 |
| 1990)。このように堆積物中の砒素の挙動は表層の生物と主要な金属元素の挙動に支配されているのです。 5.おわりに 堆積物中の砒素の挙動は、表層の生物生産や金属元素の挙動に密接に関わっていることがわかったでしょうか?実際には海底における酸化還元環境状態は、海底に到達する有機物量とその分解反応速度によります。したがって、この変化に対応する金属元素の挙動についても、海洋の表層の生物生産=海底に到達する有機物量に影響を受けるので、砒素の海底での挙動は表層の生物生産が決めていると言っても過言ではありません。最近では分析の技術も進歩しモノメチルアルソン酸(CH3AsO(OH)2)、ジメチルアルシン酸((CH3)2AsO(OH))など有機態の砒素を直接測定することも可能になってきており、土佐湾や琵琶湖の水の分析が行われています(Sohrin et al., 1997;Hasegawa, 1996) 。今後堆積物や間隙水の分析を行えば、堆積物中における更に詳しい砒素の挙動が明らかになるものと期待されます。 <参考文献> (1)角皆静男、乗木新一郎(1983):海洋化学−化学で海を解く。(西村雅吉編)、産業図書、285p. (2)Masuzawa, T. (1989):Compositionnal change of settling particles with water depth in the Japan Sea. Mar. Chem., 27, 61-78. (3)Braman, R. S. and C. C. Foreback (1973):Methylated forms of arsenic in the environment. Science, 182, 1247-1249. (4)Braman, R. S. (1975):Arsenic in the environment. Arsenical pesticides, American Chemical Society Symposium Series, 7, 108-123. (5)Middelburg, J.J., D Hoede, A. Hans, Van Der Sloot, H. Cornelis, Van Der Weijden and J Wijkstra (1988):Arsenic, antimony and vanadium in the North Atlantic Ocean. Geochim. Cosmochim. Acta, 52, 2871-2878. (6)Saijo, T, and S. Ichimura (1960):Primary production in the northwestern Pacific. J. Oceanogr. Soc. Japan, 16, 139-145. (7)Takematsu, N., Y. Sato, S. Okabe and A. Usui (1990):Uptake of selenium and other oxyanionic elements in marine ferromanganese concretions of different origins. Mar. Chem., 31, 271-283. (8)Belzile, N. (1988):The fate of arsenic in sediments of the Laurentian Trough. Geochim. Cosmochim. Acta, 52, 2293-2302. (9)Sohrin, Y., M. Matsui, M. Kawashima, M. Hojo and H. Hasegawa (1997):Arsenic biogeochemistry affected by eutrophication in Lake Biwa, Japan. Environ. Sci. Technol., 31, 2712-2720. (10)Hasegawa, H (1996):Seasonal changes in methylarsenic distribution in Tosa Bay and Uranouchi inlet. Appl. Organoment. Chem., 10, 733-740. (11)田中 茂、中村 優 (1993):大気−海洋間における微量金属の生化学的循環に関する研究.平成4年 度文部省科学研究費補助金重点領域研 オーシャンフラックス−地球圏・生物圏におけるその役割− 成果報告書, 117-120. (12)Minami, H, and Y. Kato (1997):Remobilization of arsenic in Sub-Oxic sediments from the seafloor of the continental margin. J. Oceanogr. Soc. Japan, 53, 553-562. |
 |
|---|